DARI sekian banyak cara yang dilakukan untuk berdiet, tercatat hanya 10 persen orang di dunia yang justru ingin berat badannya bertambah.
Sebagian besar orang berdiet karena merasa tubuhnya mudah gemuk, sebagian kecilnya justru merasa kesulitan menambah berat badan. Jika Anda salah satu dari 10 persen ini, berikut tips yang bisa Anda coba.
1. Tetapkan target
Sebelum Anda menjalankan program penggemukan tubuh, pertama-tama Anda harus menetapkan berapa berat badan yang Anda inginkan Pastikan target Anda masih dalam batas normal agar tidak mengarah pada obesitas.
2. Perhatikan rumus
Menambah berat badan juga ada rumusnya, lho. 70-20-10 merupakan angka keramat bagi Anda yang ingin meningkatkan berat badan. Angka ini mewakili komposisi makanan yang harus Anda santap, yaitu 70% protein tanpa lemak, 20% kalori dari karbohidrat, dan 10% (atau kurang) lemak sehat. Menghitung jumlah kalori dalam makanan juga tidak hanya dilakukan orang-orang yang sedang berdiet. Untuk menambah bobot tubuh, pastikan kalori yang masuk dalam tubuh lebih besar dari kalori yang dipangkas lewat kegiatan sehari-hari.
3. Pola makan sehat
Menambah berat badan bukan berarti Anda bebas menyantap apapun dan kapanpun. Anda juga harus terus memperhatikan kesehatan dengan menghindari makanan dengan lemak jenuh atau saturated fats. Jika target Anda tidak terpenuhi dan berat badan justru semakin berkurang, periksakan diri Anda ke dokter untuk memastikan tidak ada gangguan kesehatan.
4. Jus buah
Jika orang yang berdiet disarankan meminum jus dari satu jenis buah, maka Anda yang menambah berat badan sebaiknya mengonsumsi jus yang terbuat dari bermacam-macam buah. Hasilnya, tubuh semakin berisi tapi tetap sehat.
5. Hindari minum sebelum makan
Minum sebelum makan membuat perut cepat kenyang walau hanya makan sedikit.
6. Berhenti merokok
Jika diperhatikan, mayoritas perokok aktif memiliki tubuh yang langsing. Ini disebabkan zat-zat kimia dalam rokok dapat menekan selera makan. Maka tak heran jika banyak yang memilih untuk tidak makan ketimbang puasa merokok.
7. Ngemil sebelum tidur
Metabolisme tubuh menurun saat kita tidur. Menyantap cemilan bernutrisi sebelum tidur menjadi cara termudah untuk menambah berat badan, karena tubuh mencerna makanan dengan lebih lambat.
dari Berbagai Sumber
copy by http://www.tabloidbintang.com/gaya-hidup/kesehatan/18799-7-cara-cepat-menambah-berat-badan.html
The First Blog
Sunday, January 8, 2012
Cara Menambah Berat Badan | Cara cepat menggemukkan badan
Tips supaya berat badan menjadi bertambah dan berisi berikut adalah tipsnya supaya anda cepat dalam melakukan usaha meningkatkan atau menambah berat badan secara alami dan bertahap.
sebelumnya saya pernah menuliskan tentang cara meninggikan badan juga tips diet yang aman silahkan baca bila andatertarik dengan artikel tersebut.
baiklah kalau begitu kita langsung saya ke topik pembahasan Cara Menambah Berat Badan dengan cara yang alami dan sangat bisa dilakukan oleh siapa saja.
1. Olahraga
Dengan olahraga tubuh akan menjadi sehat, sehingga fungsi tubuh pun akan baik. Usahakan setidaknya dalam satu minggu minimal olah raga sekali. Dengan bentuk olah raga yang dapat membuat anda setidaknya berkeringat.
2. Minum susu
Susu selain sehat juga dapat menggemukkan badan anda, khususnya susu full cream. Disarankan untuk minum susu jenis full cream dua kali sehari.
3. Kunyah makanan
Saat makanan di dalam mulut maka kunyahlah sampai halus. Hal ini dilakukan untuk mempermudah kerja lambung. Apalagi makan-makanan yang sulit dicerna. Karena selain di mulut tidak ada lagi gigi di tempa tlain.
4. Makan dengan teratur
Setiap hari makanlah dengan teratur. Selalu sarapan di pagi hari, makan siang tepat waktu kemudian makan malam. Dan di antaranya dapat diselingi makanan tertentu.
5. Jenis makanan
Jenis makanan yang anda makan sesuaikan dengan aktivitas anda. Jika anda seorang yang banyak bergerak maka makanlah yang banyak mengandung karbohidrat atau lemak. Karena jika kelebihan, maka karbohidrat dan lemak akan ditimbun. Berbeda dengan protein yang tidak akan ditimbun tubuh.
6. Tidur yang cukup.
Tubuh kita minimal butuh waktu 8 jam untuk istirahat. Usahakan untuk selalu tidur siang.
7. Kurangi merokok dan begadang.
Apabila kamu merokok, maka kurangi hal tersebut, dan apabila kamu sering begadang maka hilangkan kebiasaan itu.
8. Jika memungkinkan, konsumsi putih telur satu kali sehari.
9. Periksa kesehatan anda
Jika anda pernah gemuk dan kemudian kurus coba cek kesehatan anda. Jika bukan karena penyakit maka setidaknya dengan tips cara cepat menggemukkan badan ini anda sudah ada perubahan dalam waktu satu bulan.
Nah jika semua tips Cara Menambah Berat Badan diatas anda lakukan insya Allah semua usaha anda akan berhasil.
perlu di ingat bila anda mendapati kegagalan mungkin ada beberapa faktor yang tidak bisa kita hindari, antara lain adalah faktor genetik, itu salah satunya.
Semoga bermanfaat untuk anda semuanya
== dari berbagai sumber tips kesehatan
copy by http://www.niamblog.com/cara-menambah-berat-badan/
Tips supaya berat badan menjadi bertambah dan berisi berikut adalah tipsnya supaya anda cepat dalam melakukan usaha meningkatkan atau menambah berat badan secara alami dan bertahap.
sebelumnya saya pernah menuliskan tentang cara meninggikan badan juga tips diet yang aman silahkan baca bila andatertarik dengan artikel tersebut.
baiklah kalau begitu kita langsung saya ke topik pembahasan Cara Menambah Berat Badan dengan cara yang alami dan sangat bisa dilakukan oleh siapa saja.
1. Olahraga
Dengan olahraga tubuh akan menjadi sehat, sehingga fungsi tubuh pun akan baik. Usahakan setidaknya dalam satu minggu minimal olah raga sekali. Dengan bentuk olah raga yang dapat membuat anda setidaknya berkeringat.
2. Minum susu
Susu selain sehat juga dapat menggemukkan badan anda, khususnya susu full cream. Disarankan untuk minum susu jenis full cream dua kali sehari.
3. Kunyah makanan
Saat makanan di dalam mulut maka kunyahlah sampai halus. Hal ini dilakukan untuk mempermudah kerja lambung. Apalagi makan-makanan yang sulit dicerna. Karena selain di mulut tidak ada lagi gigi di tempa tlain.
4. Makan dengan teratur
Setiap hari makanlah dengan teratur. Selalu sarapan di pagi hari, makan siang tepat waktu kemudian makan malam. Dan di antaranya dapat diselingi makanan tertentu.
5. Jenis makanan
Jenis makanan yang anda makan sesuaikan dengan aktivitas anda. Jika anda seorang yang banyak bergerak maka makanlah yang banyak mengandung karbohidrat atau lemak. Karena jika kelebihan, maka karbohidrat dan lemak akan ditimbun. Berbeda dengan protein yang tidak akan ditimbun tubuh.
6. Tidur yang cukup.
Tubuh kita minimal butuh waktu 8 jam untuk istirahat. Usahakan untuk selalu tidur siang.
7. Kurangi merokok dan begadang.
Apabila kamu merokok, maka kurangi hal tersebut, dan apabila kamu sering begadang maka hilangkan kebiasaan itu.
8. Jika memungkinkan, konsumsi putih telur satu kali sehari.
9. Periksa kesehatan anda
Jika anda pernah gemuk dan kemudian kurus coba cek kesehatan anda. Jika bukan karena penyakit maka setidaknya dengan tips cara cepat menggemukkan badan ini anda sudah ada perubahan dalam waktu satu bulan.
Nah jika semua tips Cara Menambah Berat Badan diatas anda lakukan insya Allah semua usaha anda akan berhasil.
perlu di ingat bila anda mendapati kegagalan mungkin ada beberapa faktor yang tidak bisa kita hindari, antara lain adalah faktor genetik, itu salah satunya.
Semoga bermanfaat untuk anda semuanya
== dari berbagai sumber tips kesehatan
copy by http://www.niamblog.com/cara-menambah-berat-badan/
Puisi Cinta Sejati
By : Ratu
Adalah
Cinta yang menguatkan..
Menjadikan jalan kebaikan..
Membuat istana indah dengan ketulusan..
Menyingkirkan segala kegelisahan..
Ketenangan..
Adalah
Cinta yang mengajari..
Memberikan arti tanpa henti..
Bersabar..
Kasih sayang..
Keimanan..
Kerinduan..
Keharmonisan..
Ketakwaan..
Adalah..
Cinta yang berfikir..
Cinta yang menjaga..
Cinta yang selalu mengerti..
Cinta yang bersabar..
dan Kamu.. Cinta yang terpendam..
Adalah..
Cinta sejati..
Tempat naungan para jiwa-jiwa suci..
Hubungan yang tak akan pernah putus dengan iri, benci..
Cinta yang menguatkan..
dan cinta yang agung menyenangkan..
Adalah..
Cinta sejati..
Tujuanku berada di bumi..
Mencari.. Tanpa henti..
Cinta yang menguatkan..
Menjadikan jalan kebaikan..
Membuat istana indah dengan ketulusan..
Menyingkirkan segala kegelisahan..
Ketenangan..
Adalah
Cinta yang mengajari..
Memberikan arti tanpa henti..
Bersabar..
Kasih sayang..
Keimanan..
Kerinduan..
Keharmonisan..
Ketakwaan..
Adalah..
Cinta yang berfikir..
Cinta yang menjaga..
Cinta yang selalu mengerti..
Cinta yang bersabar..
dan Kamu.. Cinta yang terpendam..
Adalah..
Cinta sejati..
Tempat naungan para jiwa-jiwa suci..
Hubungan yang tak akan pernah putus dengan iri, benci..
Cinta yang menguatkan..
dan cinta yang agung menyenangkan..
Adalah..
Cinta sejati..
Tujuanku berada di bumi..
Mencari.. Tanpa henti..
Ada 2 macam penyakit:
- Penyakit Jasmani
- Penyakit Jiwa
Penyakit Jasmani
Penyakit Jasmani adalah penyakit yang sudah banyak kita kenal dan hampir seluruh manusia pernah mengalaminya. Hal tersebut dapat kita obati dengan cara secara medis maupun secara tradisionil/pengobatan alternative.
Penyakit Jiwa
Sedangkan penyakit Jiwa adalah penyakit yang berasal dari dalam diri manusia itu sendiri yang mengakibatkan terganggunya system syaraf,sehinga mengakibatkan gerak gerik dari pada manusia tersebut menjadi tidak terkontrol atau tidak normal.
Sifat-sifat yang banyak menimbulkan penyakit dan menggerogoti jiwa seperti;
- HASAD (iri hati)
- HAQAD (dengki atau benci) SUUZ-ZAN (sangka buruk)
- KIBIR (sombong) UJUB (merasa sempurna diri dari orang lain)
- RIYA (memamerkan kelebihan)
- SUMA (cari-cari nama atau kemasyuran)
- BUKHUL (kikir)
- HUBBUL MAL (kebendaan)
- TAFAHUR (membanggakan diri)
- GHADAB (pemarah)
- GHIBAH (pengumpat)
- NAMINAH (bicara belakang orang)
- KIZIB (dusta)
- KHIANAT (munafik)
Cara Membersihkan Diri
- Niat yang baik dan benar
- Tidak menyekutukan Allah/syirik
- Sholat diawal waktu
- Perbanyak sholat sunah
- Tidak batal wudhu
- Perbanyak baca Al Quran
- Perbanyak wirid/zikir
- Tidak menyia-nyiakan perkataan dan perbuatan
- Kurangi makan
- Kurangi tidur.
Metode Pengobatan
- Metode pengobatan yang dijalankan Oleh Ki Sidhik Pangestu adalah:
- Penggunaan obat Tradisional maupun modern
- Meditasi
- Pemijatan
- Puasa
- Doa
- Penyerahan diri Kepada Yang Maha Kuasa
Copyright © S P I R I T U A L - 1999
- Penyakit Jasmani
- Penyakit Jiwa
Penyakit Jasmani
Penyakit Jasmani adalah penyakit yang sudah banyak kita kenal dan hampir seluruh manusia pernah mengalaminya. Hal tersebut dapat kita obati dengan cara secara medis maupun secara tradisionil/pengobatan alternative.
Penyakit Jiwa
Sedangkan penyakit Jiwa adalah penyakit yang berasal dari dalam diri manusia itu sendiri yang mengakibatkan terganggunya system syaraf,sehinga mengakibatkan gerak gerik dari pada manusia tersebut menjadi tidak terkontrol atau tidak normal.
Sifat-sifat yang banyak menimbulkan penyakit dan menggerogoti jiwa seperti;
- HASAD (iri hati)
- HAQAD (dengki atau benci) SUUZ-ZAN (sangka buruk)
- KIBIR (sombong) UJUB (merasa sempurna diri dari orang lain)
- RIYA (memamerkan kelebihan)
- SUMA (cari-cari nama atau kemasyuran)
- BUKHUL (kikir)
- HUBBUL MAL (kebendaan)
- TAFAHUR (membanggakan diri)
- GHADAB (pemarah)
- GHIBAH (pengumpat)
- NAMINAH (bicara belakang orang)
- KIZIB (dusta)
- KHIANAT (munafik)
Cara Membersihkan Diri
- Niat yang baik dan benar
- Tidak menyekutukan Allah/syirik
- Sholat diawal waktu
- Perbanyak sholat sunah
- Tidak batal wudhu
- Perbanyak baca Al Quran
- Perbanyak wirid/zikir
- Tidak menyia-nyiakan perkataan dan perbuatan
- Kurangi makan
- Kurangi tidur.
Metode Pengobatan
- Metode pengobatan yang dijalankan Oleh Ki Sidhik Pangestu adalah:
- Penggunaan obat Tradisional maupun modern
- Meditasi
- Pemijatan
- Puasa
- Doa
- Penyerahan diri Kepada Yang Maha Kuasa
Copyright © S P I R I T U A L - 1999
Sunday, November 14, 2010
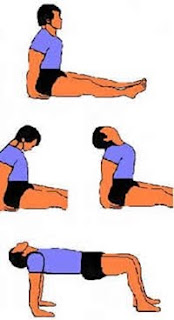
Gerakan-gerakan Untuk Meninggikan Badan
- Lakukan cara-cara ini selama 3 minggu secara teratur dan berturut-turut. Tinggi anda akan bertambah 2-4 Inchi (5-10cm).
- Jangan sampai melewatkan satu pun gerakan ini, karena hasilnya tidak akan maksimal.
- Anda hanya membutuhkan waktu kurang dari 1 jam dalam sehari untuk melaksanakan semua gerakan ini.
- Cara ini bisa dipraktekkan oleh siapa saja tanpa memandang usia.

1. Tahan gerakan 5-30 detik, setelah itu istirahat 5-30 detik.

2. Tahan gerakan 10-20 detik, setelah itu istirahat 10-20 detik.

3. Tahan gerakan 3-8 detik, setelah itu istirahat 3-8 detik.

4. Tahan gerakan 6-15 detik, setelah itu istirahat 6-15 detik.

5. Tahan gerakan 3-10 detik, setelah itu istirahat 3-10 detik.
6. Tahan gerakan 8-20 detik, setelah itu istirahat 8-20 detik.

7. Tahan gerakan 4-8 detik, setelah itu istirahat 4-8 detik.

8. Tahan gerakan 5-15 detik, setelah itu istirahat 5-15 detik.

9. Tahan gerakan 4-7 detik, setelah itu istirahat 4-7 detik.

10. Tahan gerakan 4-8 detik, setelah itu istirahat 4-8 detik.

11. Tahan gerakan 4-6 detik, setelah itu istirahat 4-6 detik.

12. Tahan gerakan 2-4 detik, setelah itu istirahat 2-4 detik.

13. Tahan gerakan 3-5 detik, setelah itu istirahat 3-5 detik.

14. Tahan gerakan 3-5 detik, setelah itu istirahat 3-5 detik.

15. Tahan gerakan 2-3 detik, setelah itu istirahat 2-3 detik.

16. Tahan gerakan 3-4 detik, setelah itu istirahat 3-4 detik.

17. Tahan gerakan 3 detik, setelah itu istirahat 3 detik.

18. Tahan gerakan 3 detik, setelah itu istirahat 3 detik.

19. Tahan gerakan 5 detik, setelah itu istirahat 5 detik.

20. Tahan gerakan 4-5 detik, setelah itu istirahat 4-5 detik.

21. Tahan gerakan 4-5 detik, setelah itu istirahat 4-5 detik.

22. Tahan gerakan 6-8 detik, setelah itu istirahat 6-8 detik.

23. Tahan gerakan 5 detik, setelah itu istirahat 5 detik.
24. Tahan gerakan 4-6 detik, setelah itu istirahat 4-6 detik.

25. Tahan gerakan 10-15 detik, setelah itu istirahat 10-15 detik.

26. Tahan gerakan 6 detik, setelah itu istirahat 6 detik.

27. Tahan gerakan 4-7 detik, setelah itu istirahat 4-7 detik.

28. Tahan gerakan 8-15 detik, setelah itu istirahat 8-15 detik.
Setelah semua gerakan sudah anda lakukan, saya anjurkan anda segera istirahat selama 15-30 menit. Setelah itu lakukan prosedur tambahan sebagai berikut:
1. Berenanglah selama 20-30 menit. Renang memberi efek berkurangnya gaya gravtasi dan akan membuat sendi dan tulang anda melonggar, dan akan memaksimalkan pertumbuhan tulang anda.
2. Bergelantunglah selama 10 detik untuk hari pertama, dan jika anda sudah terbiasa anda akan dapat bergelantungan selam 30 menit! Ini dapat memberi efek gravitasi yang menarik anda untuk memaksa tubuh anda untuk tumbuh.
3. Lakukan loncat tali sebanyak 500 kali loncatan.
4. Berlari santailah layaknya lari pagi sejauh 400-500 meter dalam sehari. Jika tidak kuat, dalam sehari anda dapat memisahkannya dalam 2 kali sehari.
5. Bersepedalah selama 20 menit. Namun, atur jarak sadel dan pedal sepeda hingga anda bisa mengayuhnya dengan cara menjinjit.
6. Pijatlah bagian-bagian sendi untuk melancarkan peredaran darah.
7. Tidur dapat benar-benar memaksimalkan pertumbuhan anda, karena Hormon Pertumbuhan akan bertambah dan terbentuk lebih maksimal jika anda tidur. Tidurlah minimal 8-12 jam sehari. Jika perlu, setiap waktu luang harus anda isi dengan tidur. Saya anjurkan tidur dalam posisi lurus dan tidak menghadap ke kiri atau ke kanan, dan juga pakailah bantal dengan ukuran kecil/pendek.
8. Makanlah makanan yang dapat merangsang pertumbuhan anda seperti:
- Kalsium, Kalsium akan memaksimalkan pertumbuhan tulang. Contoh: Susu, dll.
- Protein, Protein akan membantu pembentukan tubuh. Contoh: Ikan, dll.
- Suplemen, pakailah suplemen untuk tambahan rangsangan pertumbuhan.
sumber: http://hermawayne.blogspot.com/2010/09/cara-meninggikan-badan.html
Saturday, October 30, 2010
Tugas Kimia
Kalorimeter
Kalorimeter adalah suatu sistem terisolasi (tidak ada perpindahan materi maupun energy dengan lingkungan diluar kalorimeter). Pengukuran jumlah kalor reaksi yang diserap atau dilepaskan pada suatu reaksi kimia dengan eksperimen disebut kalorimetri. Kita dapat menghitung perubahan suhu dengan rumus :
q = m . c . ∆T (Petrucci, 1987).
qkalorimeter=C. ∆T
Keterangan :
q = jumlah kalor (Joule)
m = massa zat (gram)
Δt = perubahan suhu( takhir - tawal)
c = kalor jenis
C = kapasitas kalor dari bom calorimeter
Oleh karena itu kalor reaksi sama dengan kalor yang diserap oleh calorimeter, sehingga :
q reaksi = -(q larutan + q kalorimeter)
Kalorimeter dibedakan menjadi beberapa macam :
1. Kalorimeter Bom.
• Merupakan kalorimeter yang khusus digunakan untuk menentukan kalor dari reaksi-reaksi pembakaran.
• Kalorimeter ini terdiri dari sebuah bom ( tempat berlangsungnya reaksi pembakaran, terbuat dari bahan stainless steel dan diisi dengan gas oksigen pada tekanan tinggi ) dan sejumlah air yang dibatasi dengan wadah yang kedap panas.
• Reaksi pembakaran yang terjadi di dalam bom, akan menghasilkan kalor dan diserap oleh air dan bom.
• Oleh karena tidak ada kalor yang terbuang ke lingkungan, maka :
qreaksi = – (qair + qbom )
• Jumlah kalor yang diserap oleh air dapat dihitung dengan rumus :
qair = m x c x ∆T
dengan :
m = massa air dalam kalorimeter ( g )
c = kalor jenis air dalam kalorimeter (J / g.oC ) atau ( J / g. K )
∆T= perubahan suhu ( oC atau K )
• Jumlah kalor yang diserap oleh bom dapat dihitung dengan rumus :
qbom = Cbom x ∆T
dengan :
Cbom = kapasitas kalor bom ( J / oC ) atau ( J / K )
∆T= perubahan suhu ( oC atau K )
• Reaksi yang berlangsung pada kalorimeter bom berlangsung pada volume tetap ( DV = nol ). Oleh karena itu, perubahan kalor yang terjadi di dalam sistem = perubahan energi dalamnya.
∆E = q + w dimana w = - P. ∆V ( jika ∆V = nol maka w = nol )
maka
∆E = qv
Contoh soal :
Suatu kalorimeter bom berisi 250 mL air yang suhunya 25oC, kemudian dibakar 200 mg gas metana. Suhu tertinggi yang dicapai air dalam kalorimeter = 35oC. Jika kapasitas kalor kalorimeter = 75 J / oC dan kalor jenis air = 4,2 J / g.oC, berapakah ∆Hc gas metana?
Jawaban :
qair = m x c x ∆T
= ( 250 ) x ( 4,2 ) x ( 35 – 25 )
= 10.500 J
qbom = Cbom x ∆T
= ( 75 ) x ( 35 – 25 )
= 750 J
qreaksi = – (qair + qbom )
qreaksi = - ( 10.500 J + 750 J )
= - 11.250 J = – 11,25 kJ
200 mg CH4 = 0,2 g CH4 = ( 0,2 / 16 ) mol = 0,0125 mol
∆Hc CH4 = ( – 11,25 kJ / 0,0125 mol ) = - 900 kJ / mol ( reaksi eksoterm )
2) Kalorimeter Sederhana
• Pengukuran kalor reaksi; selain kalor reaksi pembakaran dapat dilakukan dengan menggunakan kalorimeter pada tekanan tetap yaitu dengan kalorimeter sederhana yang dibuat dari gelas stirofoam.
• Kalorimeter ini biasanya dipakai untuk mengukur kalor reaksi yang reaksinya berlangsung dalam fase larutan ( misalnya reaksi netralisasi asam – basa / netralisasi, pelarutan dan pengendapan ).
• Pada kalorimeter ini, kalor reaksi = jumlah kalor yang diserap / dilepaskan larutan sedangkan kalor yang diserap oleh gelas dan lingkungan; diabaikan.
qreaksi = – (qlarutan + qkalorimeter )
qkalorimeter = Ckalorimeter x ∆T
dengan :
Ckalorimeter = kapasitas kalor kalorimeter ( J / oC ) atau ( J / K )
∆T = perubahan suhu ( oC atau K )
• Jika harga kapasitas kalor kalorimeter sangat kecil; maka dapat diabaikan sehingga perubahan kalor dapat dianggap hanya berakibat pada kenaikan suhu larutan dalam kalorimeter.
qreaksi = – qlarutan
qlarutan = m x c x ∆T
dengan :
m = massa larutan dalam kalorimeter ( g )
c = kalor jenis larutan dalam kalorimeter (J / g.oC ) atau ( J / g. K )
∆T = perubahan suhu ( oC atau K )
• Pada kalorimeter ini, reaksi berlangsung pada tekanan tetap (∆P = nol ) sehingga perubahan kalor yang terjadi dalam sistem = perubahan entalpinya.
∆H = qp
Contoh soal :
Sebanyak 50 mL ( = 50 gram ) larutan HCl 1 M bersuhu 27 oC dicampur dengan 50 mL ( = 50 gram ) larutan NaOH 1 M bersuhu 27 oC dalam suatu kalorimeter gelas stirofoam. Suhu campuran naik sampai 33,5 oC. Jika kalor jenis larutan = kalor jenis air = 4,18 J / g.K. Tentukan perubahan entalpinya!
Jawaban :
qlarutan = m x c x ∆T
= ( 100 ) x ( 4,18 ) x ( 33,5 – 27 )
= 2.717 J
Karena kalor kalorimeter diabaikan maka :
qreaksi = – qlarutan
= - 2.717 J
Jumlah mol ( n ) HCl = 0,05 L x 1 mol / L = 0,05 mol
Jumlah mol ( n ) NaOH = 0,05 L x 1 mol / L = 0,05 mol
Oleh karena perbandingan jumlah mol pereaksi = perbandingan koefisien reaksinya maka
campuran tersebut adalah ekivalen.
∆H harus disesuaikan dengan stoikiometri reaksinya, sehingga :
q (1 mol HCl + 1 mol NaOH ) = ( 1 / 0,05 ) x ( – 2.717 J )
= – 54.340 J = – 54,34 kJ
Jadi ∆H reaksi = qreaksi = – 54,34 kJ
Soal-soal
1. Pada pemanasan 400g air bersuhu 25°C diperlukan kalor 84 kJ. Jika diketahui kalor jenis air = 4,2 J/g°C, tentukan suhu air setelah pemanasan!
2. Dalam kalorimeter bom yang memiliki kapasitas (nilai air) 125 J/ °C dan berisi 200 ml air dengan suhu 24°C dibakar sempurna 2 gr CH4 Mr=16. Bila suhu air kalorimeter menjadi 74°C dan kalor jenis air adalah 4,2 J/gC. Maka tentukan perubahan entalpi pembakaran CH4 tersebut!
3. Pencampuran 100 mL larutan HCl 2 M dan 100 mL larutan NaOH 1 M menyebabkan kenaikkan suhu larutan dari 25°C menjadi 31 ,5°C. Jika kalor jenis larutan dianggap sama dengan kalor jenis air = 4,2 J/g°C, kapasitas kalorimetri = 0 dan massa jenis air = 1 g/cm 3, tentukan ∆Hreaksi!
4. Pembakaran 32 g gas metana dalam kalorimetri menyebabkan suhu air kalorimetri naik dari 24,8°C menjadi 88,5°C. Jika kalorimetri berisi 6 L air dan diketahui kalor jenis air = 4,2 J/g°C serta kapasitas kalorimetri = 2740 J/g°C, tentukan kalor pembakaran gas metana!
Kunci jawaban:
1. q = 84 kJ = 84.000 J
q=m.c. ∆T
84.000 J = 400.(4.2) ∆T
∆T=50oC
∆T=T2-T1
50=T2-25
T2=75 oC
2. q = m c Δt + C Δt
q = 200g x 4,2 J/g C x (74-24)C + 125 J/C (74-24)C
= 48250 J = 48,25 kJ
mol CH4 = 2g / 16g/mol = 0,125 mol
0,125 mol membebaskan panas = 48,25 kJ
1 mol CH4 membebaskan panas = 1/0,125 x 48,25kJ = 386 kJ
Jadi entalpi molar pembakaran CH4 = 386 kJ/mol
3. Mol HCL = VHCL x MHCL = (0,1)(2)=(0,2)
Mol NaOH = VNaOH x MNaHO=(0,1)(1)=0,1
Mol pembatas = mol NaCl = 0,1 mol
Vlarutan = Vair = 200mL
m larutan = mair = (200) (1) = 200 g
Kalor yang diterima:
qlarutan=m.c. ∆t=(200)(4,2)(31,5-25)=5.460 J
q reaksi + q larutan=0Kalor yang dilepas reaksi: q reaksi = - q larutan = -5.460J=-5,46 kJ
Jadi ∆Hreaksi 0,1 mol = -5,46 kJ → ∆Hreaksi 1 mol = -5,46 / 0,1 = -54,6 kJ
4. qair=m.c. Δt=(6000)(4,2)(88,5-25,8)=1.605.240J=1.605,24 kJ
qkalorimeter=C. Δt=(2.740)( 88,5-25,8)=174.538J=174,538kJ
q reaksi + q larutan=0
qreaksi = – (qair + qkalorimeter) =-(1.605,24 kJ+174,538kJ)=-1.779,8kJ
∆Hreaksi = q larutan =-1.779,8kJ
Mol CH4 = = 2 mol → ∆Hpembakaran 2mol CH4 =-1.779,8kJ
∆Hc CH4 = = - 890 kJ/mol
Kalorimeter adalah suatu sistem terisolasi (tidak ada perpindahan materi maupun energy dengan lingkungan diluar kalorimeter). Pengukuran jumlah kalor reaksi yang diserap atau dilepaskan pada suatu reaksi kimia dengan eksperimen disebut kalorimetri. Kita dapat menghitung perubahan suhu dengan rumus :
q = m . c . ∆T (Petrucci, 1987).
qkalorimeter=C. ∆T
Keterangan :
q = jumlah kalor (Joule)
m = massa zat (gram)
Δt = perubahan suhu( takhir - tawal)
c = kalor jenis
C = kapasitas kalor dari bom calorimeter
Oleh karena itu kalor reaksi sama dengan kalor yang diserap oleh calorimeter, sehingga :
q reaksi = -(q larutan + q kalorimeter)
Kalorimeter dibedakan menjadi beberapa macam :
1. Kalorimeter Bom.
• Merupakan kalorimeter yang khusus digunakan untuk menentukan kalor dari reaksi-reaksi pembakaran.
• Kalorimeter ini terdiri dari sebuah bom ( tempat berlangsungnya reaksi pembakaran, terbuat dari bahan stainless steel dan diisi dengan gas oksigen pada tekanan tinggi ) dan sejumlah air yang dibatasi dengan wadah yang kedap panas.
• Reaksi pembakaran yang terjadi di dalam bom, akan menghasilkan kalor dan diserap oleh air dan bom.
• Oleh karena tidak ada kalor yang terbuang ke lingkungan, maka :
qreaksi = – (qair + qbom )
• Jumlah kalor yang diserap oleh air dapat dihitung dengan rumus :
qair = m x c x ∆T
dengan :
m = massa air dalam kalorimeter ( g )
c = kalor jenis air dalam kalorimeter (J / g.oC ) atau ( J / g. K )
∆T= perubahan suhu ( oC atau K )
• Jumlah kalor yang diserap oleh bom dapat dihitung dengan rumus :
qbom = Cbom x ∆T
dengan :
Cbom = kapasitas kalor bom ( J / oC ) atau ( J / K )
∆T= perubahan suhu ( oC atau K )
• Reaksi yang berlangsung pada kalorimeter bom berlangsung pada volume tetap ( DV = nol ). Oleh karena itu, perubahan kalor yang terjadi di dalam sistem = perubahan energi dalamnya.
∆E = q + w dimana w = - P. ∆V ( jika ∆V = nol maka w = nol )
maka
∆E = qv
Contoh soal :
Suatu kalorimeter bom berisi 250 mL air yang suhunya 25oC, kemudian dibakar 200 mg gas metana. Suhu tertinggi yang dicapai air dalam kalorimeter = 35oC. Jika kapasitas kalor kalorimeter = 75 J / oC dan kalor jenis air = 4,2 J / g.oC, berapakah ∆Hc gas metana?
Jawaban :
qair = m x c x ∆T
= ( 250 ) x ( 4,2 ) x ( 35 – 25 )
= 10.500 J
qbom = Cbom x ∆T
= ( 75 ) x ( 35 – 25 )
= 750 J
qreaksi = – (qair + qbom )
qreaksi = - ( 10.500 J + 750 J )
= - 11.250 J = – 11,25 kJ
200 mg CH4 = 0,2 g CH4 = ( 0,2 / 16 ) mol = 0,0125 mol
∆Hc CH4 = ( – 11,25 kJ / 0,0125 mol ) = - 900 kJ / mol ( reaksi eksoterm )
2) Kalorimeter Sederhana
• Pengukuran kalor reaksi; selain kalor reaksi pembakaran dapat dilakukan dengan menggunakan kalorimeter pada tekanan tetap yaitu dengan kalorimeter sederhana yang dibuat dari gelas stirofoam.
• Kalorimeter ini biasanya dipakai untuk mengukur kalor reaksi yang reaksinya berlangsung dalam fase larutan ( misalnya reaksi netralisasi asam – basa / netralisasi, pelarutan dan pengendapan ).
• Pada kalorimeter ini, kalor reaksi = jumlah kalor yang diserap / dilepaskan larutan sedangkan kalor yang diserap oleh gelas dan lingkungan; diabaikan.
qreaksi = – (qlarutan + qkalorimeter )
qkalorimeter = Ckalorimeter x ∆T
dengan :
Ckalorimeter = kapasitas kalor kalorimeter ( J / oC ) atau ( J / K )
∆T = perubahan suhu ( oC atau K )
• Jika harga kapasitas kalor kalorimeter sangat kecil; maka dapat diabaikan sehingga perubahan kalor dapat dianggap hanya berakibat pada kenaikan suhu larutan dalam kalorimeter.
qreaksi = – qlarutan
qlarutan = m x c x ∆T
dengan :
m = massa larutan dalam kalorimeter ( g )
c = kalor jenis larutan dalam kalorimeter (J / g.oC ) atau ( J / g. K )
∆T = perubahan suhu ( oC atau K )
• Pada kalorimeter ini, reaksi berlangsung pada tekanan tetap (∆P = nol ) sehingga perubahan kalor yang terjadi dalam sistem = perubahan entalpinya.
∆H = qp
Contoh soal :
Sebanyak 50 mL ( = 50 gram ) larutan HCl 1 M bersuhu 27 oC dicampur dengan 50 mL ( = 50 gram ) larutan NaOH 1 M bersuhu 27 oC dalam suatu kalorimeter gelas stirofoam. Suhu campuran naik sampai 33,5 oC. Jika kalor jenis larutan = kalor jenis air = 4,18 J / g.K. Tentukan perubahan entalpinya!
Jawaban :
qlarutan = m x c x ∆T
= ( 100 ) x ( 4,18 ) x ( 33,5 – 27 )
= 2.717 J
Karena kalor kalorimeter diabaikan maka :
qreaksi = – qlarutan
= - 2.717 J
Jumlah mol ( n ) HCl = 0,05 L x 1 mol / L = 0,05 mol
Jumlah mol ( n ) NaOH = 0,05 L x 1 mol / L = 0,05 mol
Oleh karena perbandingan jumlah mol pereaksi = perbandingan koefisien reaksinya maka
campuran tersebut adalah ekivalen.
∆H harus disesuaikan dengan stoikiometri reaksinya, sehingga :
q (1 mol HCl + 1 mol NaOH ) = ( 1 / 0,05 ) x ( – 2.717 J )
= – 54.340 J = – 54,34 kJ
Jadi ∆H reaksi = qreaksi = – 54,34 kJ
Soal-soal
1. Pada pemanasan 400g air bersuhu 25°C diperlukan kalor 84 kJ. Jika diketahui kalor jenis air = 4,2 J/g°C, tentukan suhu air setelah pemanasan!
2. Dalam kalorimeter bom yang memiliki kapasitas (nilai air) 125 J/ °C dan berisi 200 ml air dengan suhu 24°C dibakar sempurna 2 gr CH4 Mr=16. Bila suhu air kalorimeter menjadi 74°C dan kalor jenis air adalah 4,2 J/gC. Maka tentukan perubahan entalpi pembakaran CH4 tersebut!
3. Pencampuran 100 mL larutan HCl 2 M dan 100 mL larutan NaOH 1 M menyebabkan kenaikkan suhu larutan dari 25°C menjadi 31 ,5°C. Jika kalor jenis larutan dianggap sama dengan kalor jenis air = 4,2 J/g°C, kapasitas kalorimetri = 0 dan massa jenis air = 1 g/cm 3, tentukan ∆Hreaksi!
4. Pembakaran 32 g gas metana dalam kalorimetri menyebabkan suhu air kalorimetri naik dari 24,8°C menjadi 88,5°C. Jika kalorimetri berisi 6 L air dan diketahui kalor jenis air = 4,2 J/g°C serta kapasitas kalorimetri = 2740 J/g°C, tentukan kalor pembakaran gas metana!
Kunci jawaban:
1. q = 84 kJ = 84.000 J
q=m.c. ∆T
84.000 J = 400.(4.2) ∆T
∆T=50oC
∆T=T2-T1
50=T2-25
T2=75 oC
2. q = m c Δt + C Δt
q = 200g x 4,2 J/g C x (74-24)C + 125 J/C (74-24)C
= 48250 J = 48,25 kJ
mol CH4 = 2g / 16g/mol = 0,125 mol
0,125 mol membebaskan panas = 48,25 kJ
1 mol CH4 membebaskan panas = 1/0,125 x 48,25kJ = 386 kJ
Jadi entalpi molar pembakaran CH4 = 386 kJ/mol
3. Mol HCL = VHCL x MHCL = (0,1)(2)=(0,2)
Mol NaOH = VNaOH x MNaHO=(0,1)(1)=0,1
Mol pembatas = mol NaCl = 0,1 mol
Vlarutan = Vair = 200mL
m larutan = mair = (200) (1) = 200 g
Kalor yang diterima:
qlarutan=m.c. ∆t=(200)(4,2)(31,5-25)=5.460 J
q reaksi + q larutan=0Kalor yang dilepas reaksi: q reaksi = - q larutan = -5.460J=-5,46 kJ
Jadi ∆Hreaksi 0,1 mol = -5,46 kJ → ∆Hreaksi 1 mol = -5,46 / 0,1 = -54,6 kJ
4. qair=m.c. Δt=(6000)(4,2)(88,5-25,8)=1.605.240J=1.605,24 kJ
qkalorimeter=C. Δt=(2.740)( 88,5-25,8)=174.538J=174,538kJ
q reaksi + q larutan=0
qreaksi = – (qair + qkalorimeter) =-(1.605,24 kJ+174,538kJ)=-1.779,8kJ
∆Hreaksi = q larutan =-1.779,8kJ
Mol CH4 = = 2 mol → ∆Hpembakaran 2mol CH4 =-1.779,8kJ
∆Hc CH4 = = - 890 kJ/mol
Tugas Bahasa Inggris
Komp. Sek-Neg Tajur Blok D-14
Tangerang, Banten 15151
Ocktober, 30 2010
Dear Lidya,
I know if I'm wrong and maybe if you know this letter from me, you definitely do not want to read and you'll throw it away but I hope you read them so you know I'm sorry. I am very sorry because it makes our friendship relationship becomes shattered. But now I realize that you are a friend who is very meaningful in my life and you are someone who can make me smile and crying. I do not want to lose someone who means as you, for that I want you to forgive me and we became friends as usual and we also forget all the problems that occurred and we build our friendship again. I hope you understand I hope you understand my predicament and forgive me because you are the bestfriend for me. I’m so sorry my bestfriend.
Your bestfriend,
Hari
Subscribe to:
Comments (Atom)